ЛП-№(003254)-(РГ-RU) от 06.03.2025
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Цераксон, 100 мг/мл, раствор для приема внутрь.
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: цитиколин.
Каждый мл раствора содержит 104,5 мг цитиколина натрия, эквивалентно цитиколину — 100,0 мг.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата:
Каждый мл раствора содержит пропилпарагидроксибензоат – 0,25 мг, метилпарагидроксибензоат – 1,45 мг, сорбитол 70 % – 200,0 мг (см. раздел 4.4.).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Раствор для приема внутрь.
Прозрачная бесцветная или слегка желтоватая жидкость с характерным клубничным запахом.
4. КЛИНИЧЕСКИЕ ДАННЫЕ
4.1 Показания к применению
Цераксон показан к применению у взрослых по следующим показаниям:
— Острый период ишемического инсульта (в составе комплексной терапии).
— Восстановительный период ишемического и геморрагического инсультов.
— Черепно-мозговая травма (ЧМТ), острый (в составе комплексной терапии) и восстановительный период.
— Когнитивные и поведенческие нарушения при дегенеративных и сосудистых заболеваниях головного мозга.
4.2 Режим дозирования и способ применения.
Режим дозирования
Острый период ишемического инсульта и черепно-мозговой травмы (ЧМТ):
1000 мг (10 мл или 1 пакетик) каждые 12 ч. Длительность лечения не менее 6 недель.
Восстановительный период ишемического и геморрагического инсультов, восстановительный период ЧМТ, когнитивные и поведенческие нарушения при дегенеративных и сосудистых заболеваниях головного мозга:
500-2000 мг в день (5–10 мл 1–2 раза в день или 1 пакетик (1000 мг) 1–2 раза в день).
Дозировка и длительность лечения в зависимости от тяжести симптомов заболевания.
Особые группы пациентов
Пациенты пожилого возраста
Корректировка дозы у пациентов пожилого возраста не требуется.
Дети
Безопасность и эффективность препарата Цераксон у детей до 18 лет не установлены. Соответствующие клинические данные отсутствуют.
Способ применения
Цераксон раствор для приема внутрь назначается перорально. Перед применением препарат можно развести в небольшом количестве воды (120 мл или ½ стакана). Принимают во время еды или между приемами пищи.
Инструкция по использованию прилагаемого к флакону дозировочного шприца:
1. Поместить дозировочный шприц во флакон (поршень шприца полностью опущен).
2. Осторожно потянуть за поршень дозировочного шприца, пока уровень раствора не сравняется с соответствующей отметкой на шприце.
3. Перед приемом нужное количество раствора можно развести в 1/2 стакана воды (120 мл).
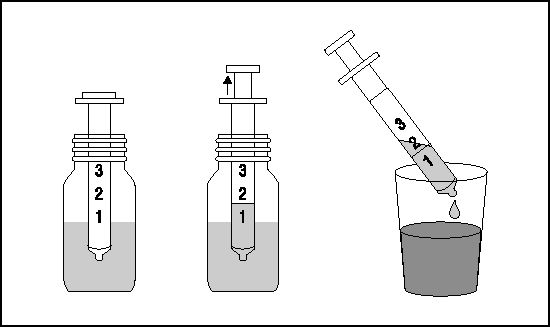
После каждого использования рекомендуется промывать дозировочный шприц водой.
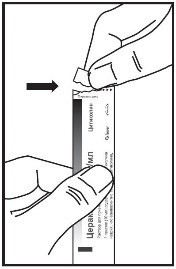
Рекомендации по применению препарата Цераксон в пакетиках:
1. Придерживая пакетик вертикально, осторожно оторвать его край по отметке «Открывать здесь».
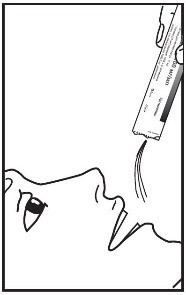
2. Содержимое пакетика можно выпить непосредственно после вскрытия
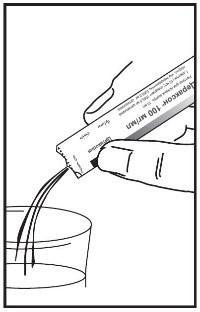
или перед приемом можно развести в 1/2 стакана воды (120 мл).
4.3 Противопоказания
- Гиперчувствительность к цитиколину натрия или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
- Выраженная ваготония (преобладание тонуса парасимпатической части вегетативной нервной системы).
- Редкие наследственные заболевания, связанные с непереносимостью фруктозы.
4.4 Особые указания и меры предосторожности при применении
На холоде может образоваться незначительное количество кристаллов вследствие временной частичной кристаллизации консерванта. При дальнейшем хранении в рекомендуемых условиях кристаллы растворяются в течение нескольких месяцев. Наличие кристаллов не влияет на качество препарата.
Информация, касающаяся вспомогательных веществ
Цераксон, раствор для приема внутрь, содержит сорбитол, поэтому данный препарат не следует назначать пациентам с наследственными заболеваниями, связанными с непереносимостью фруктозы.
Цераксон, раствор для приема внутрь, содержит содержит пара-гидроксибензоаты в виде пропиловых и метиловых эфиров, которые могут вызывать аллергические реакции (возможно, замедленного типа).
4.5 Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Цитиколин усиливает эффекты леводопы.
Не следует применять одновременно с лекарственными средствами, содержащими меклофеноксат.
4.6 Фертильность, беременность и лактация
Беременность
Достаточные данные по применению цитиколина у беременных женщин отсутствуют. Хотя в исследованиях на животных отрицательного влияния не выявлено, в период беременности лекарственный препарат Цераксон назначают только в тех случаях, когда ожидаемая польза для матери превосходит потенциальный риск для плода.
Лактация
При назначении лекарственного препарата Цераксон в период лактации женщинам следует прекратить грудное вскармливание, поскольку данные о выделении цитиколина с женским молоком отсутствуют.
4.7 Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Цераксон не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
4.8 Нежелательные реакции
Нежелательные реакции, возникавшие при лечении препаратом Цераксон в ходе клинических исследований и опыта пострегистрационного применения, перечислены ниже в соответствии с терминами предпочтительного употребления медицинского словаря для нормативно-правовой деятельности (MedDRA), классами систем органов и частотой встречаемости.
Частоту определяют следующим образом: очень часто (≥ 1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), неизвестно (невозможно оценить на основании имеющихся данных). Внутри каждой категории частоты нежелательные реакции перечислены в порядке убывания степени серьезности.
Класс систем органов | Термин предпочтительного употребления | Частота встречаемости: очень редко (<1/10000), включая отдельные сообщения |
Нарушения со стороны иммунной системы | аллергические реакции (сыпь, кожный зуд, анафилактический шок) | Очень редко |
Нарушения метаболизма и питания | снижение аппетита | Очень редко |
Психические нарушения | галлюцинации, бессонница, возбуждение | Очень редко |
Нарушения со стороны нервной системы | головная боль, головокружение, чувство жара, тремор | Очень редко |
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | одышка | Очень редко |
Желудочно-кишечные нарушения | тошнота, рвота, диарея | Очень редко |
Нарушения со стороны мышечной, скелетной и соединительной ткани | онемение в парализованных конечностях | Очень редко |
Общие нарушения и реакции в месте введения | отеки, озноб | Очень редко |
Лабораторные и инструментальные данные | изменение активности печеночных ферментов | Очень редко |
В некоторых случаях Цераксон может стимулировать парасимпатическую систему, а также оказывать кратковременное изменение артериального давления.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата.
Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза:
Российская Федерация
109012, Москва, Славянская площадь, д. 4, строение 1
Федеральная служба по надзору в сфере здравоохранения (РОСЗДРАВНАДЗОР)
Телефон: +7 (499) 578-06-70
Электронная почта: pharm@roszdravnadzor.gov.ru
Адрес в интернете: www.roszdravnadzor.gov.ru
Республика Казахстан
010000, г. Астана, район Байконыр, ул. А.Иманова, 13 (БЦ «Нурсаулет 2»),
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
Тел.: +7 (7172) 23-51-35
Электронная почта: farm@dari.kz
Сайт в информационно-телекоммуникационной сети «Интернет»:
www.ndda.kz
Республика Беларусь
220037, Минск, Товарищеский пер., 2a
Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении»
Телефон: +375 (17) 242-00-29
Факс: +375 (17) 242-00-29
Электронная почта: rcpl@rceth.by
Сайт в информационно-телекоммуникационной сети «Интернет»:
www.rceth.by
4.9 Передозировка
Симптомы
С учетом низкой токсичности препарата случаи передозировки не описаны.
Лечение
В случае передозировки показано симптоматическое лечение.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1 Фармакодинамические свойства
Фармакотерапевтическая группа: психоаналептики; психостимуляторы, средства, применяемые при синдроме дефицита внимания с гиперактивностью, и ноотропные средства; другие психостимуляторы и ноотропные средства.
Код ATХ: N06BX06.
Механизм действия
Цитиколин стимулирует биосинтез структурных фосфолипидов мембран нейронов, что подтверждено в исследованиях с применением магнитно-резонансной спектроскопии. Посредством этого действия цитиколин способствует улучшению работы мембранных механизмов, таких как работа ионно-обменных насосов и рецепторов, задействованных в этой работе, модуляция которых является необходимой при передаче нервных сигналов.
Фармакодинамические эффекты
Цитиколин, являясь предшественником ключевых ультраструктурных компонентов клеточной мембраны (преимущественно фосфолипидов), обладает широким спектром действия – способствует восстановлению поврежденных мембран клеток, ингибирует действие фосфолипаз, препятствует избыточному образованию свободных радикалов, а также предотвращает гибель клеток, воздействуя на механизмы апоптоза.
Клиническая эффективность и безопасность
В остром периоде инсульта цитиколин уменьшает объем поражения ткани головного мозга, улучшает холинергическую передачу. При черепно-мозговой травме уменьшает длительность посттравматической комы и выраженность неврологических симптомов, кроме этого, способствует уменьшению продолжительности восстановительного периода.
При хронической гипоксии головного мозга цитиколин эффективен в лечении когнитивных расстройств таких, как ухудшение памяти, безынициативность, затруднения, возникающие при выполнении повседневных действий и самообслуживании. Повышает уровень внимания и сознания, а также уменьшает проявление амнезии.
Цитиколин эффективен в лечении чувствительных и двигательных неврологических нарушений дегенеративной и сосудистой этиологии.
5.2 Фармакокинетические свойства
Абсорбция
Цитиколин хорошо абсорбируется при приеме внутрь. После приема концентрация холина в плазме крови существенно повышается. Абсорбция после перорального применения практически полная, а биодоступность приблизительно такая же, как и после внутривенного введения.
Распределение
Цитиколин в значительной степени распределяется в структурах головного мозга, с быстрым внедрением фракции холина в структурные фосфолипиды и фракции цитидина – в цитидиновые нуклеотиды и нуклеиновые кислоты. Цитиколин проникает в головной мозг и активно встраивается в клеточные, цитоплазматические и митохондриальные мембраны, образуя часть фракции структурных фосфолипидов.
Биотрансформация
Препарат метаболизируется в кишечнике и в печени с образованием холина и цитидина.
Элиминация
Только 15% введенной дозы цитиколина выводится из организма человека: менее 3% – с мочой и калом и около 12% – с выдыхаемым CO2.
В экскреции цитиколина с мочой можно выделить 2 фазы: первая фаза, длящаяся около 36 часов, в ходе которой скорость выведения быстро снижается, и вторая фаза, в ходе которой скорость экскреции снижается намного медленнее. То же самое наблюдается в выдыхаемом CO2 – скорость выведения быстро снижается приблизительно в течение первых 15 часов, а затем снижается намного медленнее.
5.3 Данные доклинической безопасности
В исследованиях хронической токсичности при пероральном приеме (в дозе 1,5 г/кг/сут в течение 6 месяцев у собак) и внутрибрюшинном способе введения (в дозе 1 г/кг/сут в течение 12 недель у крыс) не было обнаружено значимых отклонений, связанных с применением препарата.
Цитиколин применялся у кроликов альбиносов, в дозе 800 мг/кг в фазе органогенеза (7-18 день беременности). Животные были препарированы на 29 день, тщательно исследовались зародыши и самки. У матерей и у зародышей не было обнаружено признаков токсичности. Воздействие на органогенез был незначительным, только в 10% случаев у изученных эмбрионов наблюдалось незначительное отставание черепного остеогенеза.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1 Перечень вспомогательных веществ
Сорбитол 70 %
Глицерол
Метилпарагидроксибензоат
Пропилпарагидроксибензоат
Натрия цитрат
Натрия сахаринат
Ароматизатор клубничный [эссенция клубничная 1487-S-Lucta]
Калия сорбат
Лимонная кислота, раствор 50%
Вода очищенная.
6.2 Несовместимость
Не применимо.
6.3 Срок годности
3 года.
6.4 Особые меры предосторожности при хранении
Хранить при температуре не выше 25 ºC. Хранить в недоступном для детей месте!
6.5 Характер и содержание упаковки
По 30 мл препарата во флаконе из бесцветного прозрачного стекла, укупоренного завинчивающейся пластиковой крышкой, обеспечивающей контроль первого вскрытия. Флакон вместе с дозировочным шприцем и листком-вкладышем помещают в картонную пачку, имеющую внутри перегородки.
или
По 10 мл препарата в пакетиках, скрепленных по два отрывным швом, из комбинированного материала (полиэтилентерефталат/полистирол/алюминиевая фольга/ полимерная пленка Сурлин). По 6 или 10 пакетиков, скрепленных по два отрывным швом, вместе с листком-вкладышем помещают в картонную пачку с перфорацией для контроля первого вскрытия.
или
По 10 пакетиков, скрепленных по два отрывным швом, вместе с листком-вкладышем помещают в промежуточную картонную пачку с перфорацией для контроля первого вскрытия. По 3 промежуточных картонных пачки помещают в потребительскую картонную пачку с перфорацией для контроля первого вскрытия.
6.6 Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним
Нет особых требований к утилизации.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
Ferrer Internacional, S.A., Spain
Gran Via Carlos III, 94, 08028, Barcelona, Spain
Феррер Интернасьональ, С.А., Испания
Гран Виа Карлос III, 94, 08028, Барселона, Испания
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Берлин-Хеми/А.Менарини»
123112, Москва, Пресненская набережная, д. 10, БЦ «Башня на Набережной», Блок Б
Телефон: +7 (495) 785-01-00
Факс: +7 (495) 785-01-01
Эл. почта: office-russia@berlin-chemie.com
Республика Казахстан
Филиал АО «Берлин-Хеми АГ» в Республике Казахстан
050051, г. Алматы, ул. Луганского, д. 54, коттедж № 2
Телефон: +7 (727) 244-6183, +7 (727) 244-6184, +7 (727) 244-6185
Эл. почта: Kazakhstan@berlin-chemie.com
Республика Беларусь
Представительство компании Берлин-Хеми АГ
220004, г. Минск, ул. Замковая, д. 27, офис 2
Телефон: +(375 17) 270-26-80, +(375 17) 270-26-81
Факс: +(375 17) 270-26-84
Эл. почта: bc-bel-minsk@berlin-chemie.com
8. НОМЕР(-А) РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРИГИСТРАЦИИ)
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
Общая характеристика лекарственного препарата Цераксон доступна на информационном портале Евразийского союза в информационно-коммуникационной сети «Интернет» http://eec.eaeunion.org/.
*Общая характеристика лекарственного препарата
